
Nanobiosensor
Biosensorer er under rask utvikling gjennom bruk av nanoteknologi og benyttes gjerne i medisinsk sammenheng. Nanobiosensorer har potentisalet til å forbedre behandlingsmuligheter og diagnosemetoder.
Definisjon av biosensor
Ordet biosensor er en forkortelse for biologiske sensorer. Disse sensorene er selektive (orginalt basert på følsomheten) til et biologisk materiale. Det vil si en fellesbetegnelse på sensorer som kan bestemme en spesifikk forbindelse ut fra en biokjemisk reaksjon. Biosensorer bruker biologisk materiale som for eksempel bakterier eller enzymer som bestanddeler av selve sensoren. De brukes for å analysere tilstedeværelse av spesifikke stoffer. Som reaksjon på dette skiller det biologiske materialet i sensoren ut spesifikke stoffer som tas opp av en detektor. Det som utmerker bisensorer er at de er svært følsomme og kan brukes blant annet for å analysere mikromiljø [1].
Bestanddeler
En biosensor består av ulike deler med hver sin oppgave. Reseptoren er den delen av biosensoren med biologisk materiale. Det kan brukes blant annet enzymer, mikroorganismer, cellevev, antistoffer, DNA/RNA og organeller. For at materialet kan brukes må det oppfylle en del krav. Materialet må kunne detektere spesifikt ulike stoffer slik at det kun gir utslag for det stoffet som ønskes å måle. Et annet krav er at det må være stabilt under reaksjonsforholdene slik at det bevarer sin biologisk aktivitet i immobilisert tilstand, altså når det er festet i sensoren. Når materialet plasseres i sensoren ble det tatt ut av sitt opprinnelige miljø. Hvis materialet ikke oppfører seg som ønsket i den nye omgivelsen det plasseres i er den ubrukelig. Materialet må være så rent som mulig slik at dett ikke blir kontaminert eller forurenset. Urenheter vil føre til dårligere virkningsgrad.
Detektorer er neste viktige bestanddel i en biosensor. De blir også kalt transduser og kan være blant annet diverse elektroder, fotodioder og nanopartikler. De omdanner den biologiske responsen som det biologiske materialet i reseptoren sender ut til et målbart elektronisk signal. Dette kan videre bli tolket og lesbart. Forsterkeren er den den neste delen i biosensoren og behandler signalet fra transduseren. Signalet fra transduseren blir mottatt av forsterkeren og danner et lesbart signal som kan evalueres. Forsterkere er datamaskiner og/eller programvarer.
Ulike typer biosensorer
I cellebaserte biosensorer brukes det vev, mikroorganismer eller hele celler som reseptor. Disse type reseptorene er enklere å isolere siden de er større. Det medfører at de er mer stødige og har dermed en økt levetid. En ulempe er at størrelsen og den økte kompleksiteten til de cellebaserte biosensorene gjør at responstiden blir lengre og at selve sensoren blir mindre spesifikk. Den økte levetiden og enkle isolasjonen gjør at denne type sensor er billigere enn sensorer som er mer spesifikke.
Molekylære biosensorer bruker molekylære komplekser som proteiner, enzymer, antistoffer, RNA eller DNA som reseptorer. Disse er gjerne mer avansert og kan bare reagere under spesielle betingelser noe som medfører at de er veldig spesifikke. De reagerer også raskere enn cellebaserte biosensorer siden det er ikke en barriere som for eksempel en cellevegg mellom reseptoren og det som ønskes å analysere. Det brukes isolerte molekyler og komplekser. Selve isoleringsprosessen bidrar til at disse resptorene kan være forholdsvis dyre. Blant annet enzymer kan være ustabilt i isolert tilstand noe som kan redusere levetiden betraktelig. I tillegg kan enzymer kreve kofaktorer, vanligvis en forbindelse eller stoff som enzymet trenger for å fungere. Dette gjør selve respetoren enda mer avansert.
Utfordringer med biosensorer
I reseptoren er det viktig at det biologiske materialet immobiliseres uten at det mister sin biologisk aktivitet. Dette er utfordrende fordi det ikke er i sitt opprinnelige miljø og kan lett miste egenskapene som gjør at det er velegnet til bruk i biosensorer. Det er også viktig at fysiske og kjemiske parametere identifiseres slik at de blir tatt hensyn til og målingen blir dermed så pålitelig som mulig. I tillegg må reseptoren være så selektiv og sensitiv som mulig, slik at veldig små og spesifikke konsentrasjoner kan detekteres. I noen bruksområder av biosensorer er det hensiktsmessig at det er mulig å transportere sensoren enkelt med seg. Idag er det forsterkeren som har størst størrelse og er hindringen for dette. Videre utvikling innen nanoteknologi kan bidra til å blant annet løse dette problemet. Med videre forskning på ulike typer av forsterkere kan de bli mye mindre og bærbare. Elektrodene kan også ved framskritt i nanoteknologi også bli mindre og effektive. Et eksempel på dette er "Enzyme amplified immunosensor (electrochemical) based on a nanoporous oxide (Nb205) electrode. Et annet viktig forskningsfelt er printing på molekyler. Ved å gjøre dette kan det dannes spesifikke molekyler som vil tåle mer og dermed lengre levetid. De vil derfor kunne koste mindre enn de isolerte versjonene av cellebasert materiale [1,3].
Biosensorer, da særlig implanterbare biosensorer, er under rask utvikling ved hjelp av nanoteknologi. Implanterbare biosensorer kan brukes i behandling av mange sykdommer hvor for eksempel kontrollering av stoffer i blod er nødvendig. Slike sensorer har en fordel fremfor dem som er brukt i dag, da de kan kontrollere mengden av disse stoffene kontinuerlig, uten at pasienten selv må passe på eller til og med mens pasienten sover.
Bruk av nanobiosensorer
Et eksempel på en sykdom hvor bruken av slike nano-biosensorer er lovende er under diabetes behandling. For tiden brukes biosensorer hvor pasienten må stikke seg i fingeren for å få ut blod og dette blodet overføres til en biosensor. Dette kan være smertefullt, særlig for små barn. Dersom pasienten har tatt på mat/sukker før måling kan dette forurense blodet og gi for høye verdier. Dette gir igjen risiko for overdosering av insulin, noe som kan gi føling og risiko for diabetisk koma. En kontinuerlig måling av blodsukkeret uten risiko for kontaminering og vil kunne gi en mer stabil behandling, noe som er viktig for å unngå senskader av diabetes [4]. I tillegg gir slike sensorer redusert smitterisiko for helsepersonell, som ikke lenger må stikke pasienter. Flere slike typer biosensorer er under utvikling; nano-tatoveringer og plaster til glukose måling er blant dem [5,6].
Et problem med implanterbare biosensorer frem til nå har vært fremmedobjektavvisning i kroppen. Dette har igjen gitt slike biosensorer lav brukstid. Bruk av nanostrukturering på overflatene til nanobiosensorer har vist seg som et lovende verktøy til å unngå dette [7]. I tillegg må disse implanterbare biosensorene være svært små for å unngå å bli frastøtt av kroppen. De bør også implanteres med "ultra-fine needles" for å unngå vevskade. Stor vevskade øker risikoen for frastøtning fra kroppen [8].
Andre nanobiosensorer som er under utvikling inkluderer diagnoseverktøy, blant annet til kreftdiagnostisering. 2D nanomaterialer kan bli påsatt prober som brukes til deteksjon av biomarkører. Det store overflatearealet til slike stoffer kombinert med disse probene gir slike sensorer høy følsomhet og de kan dermed detektere disse stoffene med mye lavere konsentrasjoner enn dagens sensorer. Dette vil kunne gi tidligere diagnoser som vil kunne øke overlevelsessjansen betraktelig. I tillegg vil kun små prøver behøves, så for eksempel vil en blodprøve eller urinprøve være nok til å utføre testen. Dette kan igjen senke terskelen for å teste pasienter og dermed vil flere kunne oppdage kreftdiagnosen selv når det ikke var diagnosen legen primært mistenkte [9].
Det er klart at slike nanobiosensorer har potensialet til å gi økonomisk gevinst for samfunnet. Tidlig diagnostisering av kreftpasienter øker sjansene for overlevelse og bedre livskvalitet etter kreftbehandlingen [9]. På grunn av bedre deteksjon kan nanobiosensorer føre til tidligere diagnostisering enn dagens metoder. Ved bedre kontroll av blodsukkeret kan senskader av diabetes unngås, som kan føre til bedre helse hos pasientene. Dette kan gi store besparelser for samfunnet både i form av medisiner og mindre utgifter til annen helsebehandling og eventuelt trygd dersom pasientene ville blitt uføre av skadene [5].
Hvordan virker nanobiosensorer?
Grafenbasert plaster for glukosedeteksjon
Grafen er et stoff bestående av et lag karbon-atomer, hvor hvert karbon atom er bundet til tre andre karbon atomer i en bikubestruktur. Denne todimensjonale strukturen gir grafen noen eksepsjonelle egenskaper, som høy ledningsevne, transparent utseende og gode mekaniske egenskaper [10,6]. Elektronene i grafen interagerer med bikubestrukturen. Dette gir opphav til nye kvasipartikler som kalles masseløse Dirac fermioner. Disse kvasipartiklene har da de samme egenskapene til elektronene, som ladningen til ektroner, men uten massen. Uten masse får disse kvasipartiklene en høy fart rundt den effektive lyshastigheten. Denne effekten er grunnen til grafens gode elektriske egenskaper [10].
Plasteret vist på figuren ovenfor er basert på grafen. Grafen i enheten blir produsert ved bruk av CVD . Denne grafenen har få defekter i strukturen, og har derfor ikke gode nok elektrokjemisk egenskaper i seg selv for å alene detektere en analytt. En slik biosensor må derfor inkludere mange komponenter for å ha høy nok sensitivitet og selektivitet til å detektere analytten. For plasteret i figuren ovenfor må temperatursensorer, mikronåler, svette-opptak, vanntett lag og sensorer for pH og glukose inkluderes i enheten. Grafen blir dopet med gull og et lag med et gullgitter blir lagt til, og en sølv-sølvklorid motelektrode blir lagt til. Dette gir høyere elektrokjemisk aktivitet i den grafen-baserte sensoren, som øker sensitiviteten til plasteret. På grunn av de få atom-lagene hvor den elektrokjemiske deteksjonen foregår får plasteret et høyt aktivt overflateareal, noe som gir høy elektrokjemisk ytelse [6]. Etter den grafen-baserte sensoren er produsert blir den overført og trykt på et silikonbasert plaster. Den stegvise produksjonen hindrer kontaminering mellom lagene i plasteret.
Glucose oxidase er et enzym som kan benyttes til å oksidere glukose og produsere H2O2 i reaksjonen [3]. H$_2$O$_2$ kan så reduseres, og elektronene fra denne reduksjonen blir detektert av en glukosesensor i plasteret. Fordi glukosekonsentrasjonen i blod og svette er forskjellig må sensoren kalibreres før den kan brukes. I tillegg er pH forskjellig i blod og i svette, og pH i svette vil variere i forhold til mengden melkesyre som er utskilt i svetten. Glukose oxidase aktiviteten er pH avhengig, og dermed er deteksjonen av glukose også pH-avhengig. En pH sensor er derfor inkludert for å kalibrere deteksjonen mot pH-en i svetten. Glukosedeteksjonen er også temperaturavhengig, og temperatursensoren i enheten brukes derfor for å kalibrere mot temperaturen. Enheten blir derfor kontinuerlig kalibrert mot disse faktorene, og dette gir en mer pålitelig måling [6].
LSPR baserte sensorer
Av biosensorer som benytter seg av nanoteknologi kan en nevne Localized Surface Plasmon Resonance (LSPR). Plasmaoscillasjoner er ledningselektroner som svinger frem og tilbake, mens et plasmon er en kvant, liten diskret del, av en plasmaoscillasjon. LSPR og SPR kan blant annet brukes til å måle konsentrasjonen av en analytt i væsker eller til å absorbere energi i solceller. Prinsippet bak LSPR bygger på metalliske nanopartikler eller nanosfærer påført reseptorer som skal reagere med en bestemt analytt. Dersom hvitt lys sendes inn mot nanosfæren uten analytten til stede, vil plasmonet absorbere den delen av lyset som befinner seg rundt resonansfrekvensen til plasmonet. Resonansfrekvensen til plasmonet er svært sensitiv til endringer i brytningsindeksen nær nanopartikkelen, slik at når analytten kommer i kontakt med reseptoren endres brytningsindeksen rundt nanopartikkelen og slik også resonansfrekvensen til plasmonet. Endringen i resonansfrekvensen kan måles av et optisk instrument og kan brukes til å angi konsentrasjonsnivået av analytten [2].
LSPR baserte sensorer kan plasseres i to kategorier basert på om det er aggregering eller forandring i brytningsindeks som gir opphav til forandringen i LSPR. Aggregerings sensorer benytter seg av de tydelige fargeendringene som forekommer ved aggregering av nanopartikler, og denne aggregeringen kan induseres ved å funksjonalisere nanopartikler med biomolekyler. Brytningsindeks sensorer benytter seg av det faktum at LSPR er svært følsom for forandringer i brytningsindeks, som kan oppstå ved overflate-biomolekyl interaksjoner [11].
Deteksjon av interaksjoner mellom DNA-tråder var et område der en aggregerings type sensor tidlig ble benyttet. Dette ble gjort ved at to kolloidale løsninger med gull nanopartikler ble funksjonalisert med ikke komplementær DNA-tråder. Deretter ble det lagt til en DNA-tråd som var komplementær med begge DNA-trådene som var festet til gull nanopartiklene. Dette fører til at DNA trådene hybridiseres og gir aggregering av nanopartiklene. Effekten av aggregeringen er at løsningen skifter farge fra rød til mørkeblå og dermed kan det skilles mellom komplementære og ikke komplementære DNA sekvenser. De kolloidale nanopartikkel løsningen kan regenereres ved å endre ionestyrken til løsningen eller øke temperaturen over smeltepunktet av DNA [11].
Bestemmelse av kinase-aktivitet er et annet område der aggregerings sensorer har blitt benyttet. Ettersom kinase er et viktig enzym i celle metabolisme og celle kommunikasjon er det viktig deres funksjon og potensielle inhibitorer. Wang et.al benyttet seg av to typer gull nanopartikler, der den ene var funksjonalisert med kinase og den andre med avidin. Det kan tilsettes $\gamma$-biotin-ATP til løsningen med kinase-funksjonaliserte gull partikler og dette vil føre til biotinylering av gullpartiklene. Deretter kan avidin funksjonaliserte gull partikler tilsettes og dette vil føre aggregering og farge endring. Denne metoden kan også benyttes til å identifisere inhibitorer, ettersom ved tilstedeværelse av en inhibitor vil biotylerings reaksjonen ikke forekomme og aggregering/fargeendring vil være fraværende [12].
Celler i kroppen sekrerer proteiner ut i blodet. Dette gjelder også kreftceller. Enkelte proteiner vil være unike for bestemte typer kreftceller. Disse proteinene kan da benyttes som biomarkører; er de oppdaget vil cellen som sekrerte proteinet også være tilstede. Dersom en biosensor er tilgjengelig for en type kreft kan kreftcellene oppdages ved å detektere disse proteinene i blodet. Ved tidlige faser av sykdommen er det svært få av disse kreftcellene og som følge av dette er konsentrasjonen av proteinene som kan brukes til diagnose svært lav. Nanobiosensorer gir nye muligheter til å detektere disse proteinene tidligere, ettersom de har potensialet til å ha høyere sensitivitet enn andre biosensorer [9,13].
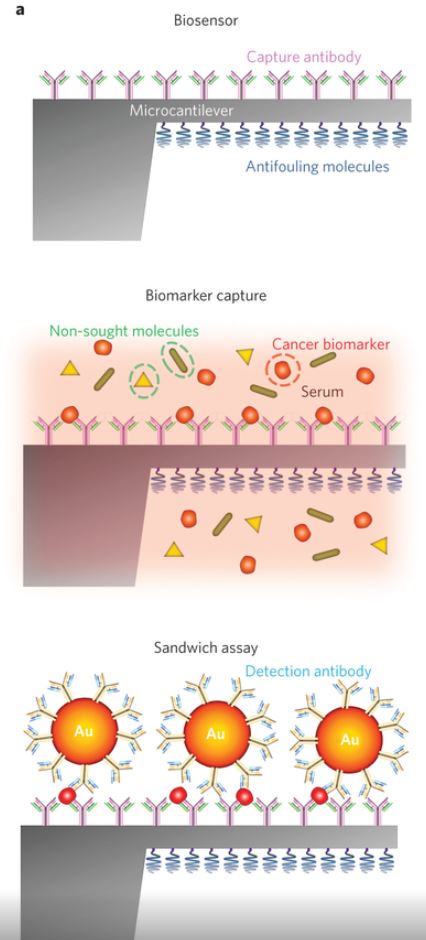
Nanobiosensoren utviklet av Kosaka et al. er bruker to antistoffer i sensoren, en som reseptor og en som detektor. Den ene er festet til en overflate på biosensoren. Dersom proteinet som skal være biomarkøren er tilstede i prøven som blir applisert på sensoren vil den fungere som et antigen og feste seg til dette antistoffet. Det andre antistoffet er festet i flertall på overflaten til en 100 nm stor gullpartikkel. Disse partiklene blir så tilsatt prøven. Dersom proteinet er tilstede vil gullpartiklene feste seg til dem. Prøven må så bli vasket for å fjerne gullpartikler som ikke har blitt festet til et protein. Gullpartikler som er festet til et protein vil da fremdeles være igjen på sensoren. Gullpartiklene blir så brukt for detektering. De har lokalisert plasmon resonans, og slike sensorer er beskrevet ovenfor. På grunn av elektromagnetisk absorbsjon og lysspredning kan en mekanisk silisium "mikrocantilever". Da får biosensoren både optomekanisk deteksjon og LSPR deteksjon. En cantilever kan betraktes som en langt prosjekterende bjelke. Når gullpartiklene fester seg på cantileveren vil tyngden av disse føre til endring i resonansfrekvens av cantileveren sammenlignet med når de ikke er tilstede [13]. Resonansfrekvensen er et resultat av vibrering av cantileveren og blir detektert optisk som i beskrivelsen av LSPR ovenfor. En laser blir så benyttet for å sende lys mot cantileveren, og avbøyningen av lysstrålen måles. Deretter blir gullpartiklene detektert av LSPR som beskrevet ovenfor. Sammensetningen av nanobiosensoren og deteksjonen optomekanisk er vist i bildet nedenfor.
Dagens nanobiosensorer har et problem med bakgrunnsstøy fra andre proteiner i blodet. Enkelte typer proteiner kan være tilstede i 10 millioner ganger høyere konsentrasjoner. Proteinene som viser kreftcellene "drukner" derfor blant de andre proteinene [13]. For å overkomme dette problemet må nanobiosensorer bli mer spesifikke. Dette kan gi falske negative eller falske positive utslag, som kan få store konsekvenser for pasienten. Nanobiosensoren utviklet av Kosaka et al. har gjort store forbedringer på dette området og har fått deteksjonsnivået ned til 10-16<\sup>g per ml blod og med falsk positive og negative tall bare rundt hver 1000 gang. Dette er fordi det er kombinerert to nanoteknologiske former for deteksjon; optomekanisk deteksjon med cantileveren og LSPR deteksjon med gullpartiklene.
- Stuen I.M. Kompendium Bioteknologi 2. akademika forlag, NTNU trykk, 2015.
- Nathan C Lindquist, Prashant Nagpal, Kevin M McPeak, David J Norris, and Sang-Hyun Oh. Engineering metallic nanostructures for plasmonics and nanophotonics. Reports on Progress in Physics Physical Society (Great Britain), 75(3), 2012.
- Reinhard Renneberg. Biotechnology for beginners. Elsevir GmBH, Academic Press, 2nd edition edition, 2006.
- H. Shamoon, H. Duffy, N. Fleischer, S. Engel, P. Saenger, M. Strelzyn, M. Litwak, J. Wylie-Rosett, A. Farkash, D. Geiger, H. Engel, J. Fleischman, D. Pompi, N. Ginsberg, M. Glover, M. Brisman, E. Walker, A. Thomashunis, and J. Gonzalez. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. New England Journal of Medicine, 329(14):977–986, 1993.
- Michael G. Bennett and R. John Naranja Jr. Getting nano tattoos right—a checklist of legal and ethical hurdles for an emerging nanomedical technology. Nanomedicine: Nanotechnology, Biology and Medicine, 9(6):729 – 731, 2013.
- Hyunjae Lee, Tae Kyu Choi, Young Bum Lee, Hye Rim Cho, Roozbeh Ghaffari, LiuWang, Hyung Jin Choi, Taek Dong Chung, Nanshu Lu, Taeghwan Hyeon, Seung Hong Choi, and Dae-Hyeong Kim. A graphene-based electrochemical device with thermoresponsive microneedles for diabetes monitoring and therapy. Nat Nano, 11(6):566–572, 2016.
- Hyunjae Lee, Tae Kyu Choi, Young Bum Lee, Hye Rim Cho, Roozbeh Ghaffari, LiuWang, Hyung Jin Choi, Taek Dong Chung, Nanshu Lu, Taeghwan Hyeon, Seung Hong Choi, and Dae-Hyeong Kim. A graphene-based electrochemical device with thermoresponsive microneedles for diabetes monitoring and therapy. Nat Nano, 11(6):566–572, 2016.
- Lu Wang, Qirong Xiong, Fei Xiao, and Hongwei Duan. 2d nanomaterials based electrochemical biosensors for cancer diagnosis. Biosensors and Bioelectronics, 89, Part 1:136 – 151, 2017. 2D Materials in Biosensors & Bioelectronics.
- K. S. Novoselov, A. K. Geim, S. V. Morozov, D. Jiang, M. I. Katsnelson, I. V. Grigorieva, S. V. Dubonos, and A. A. Firsov. Two-dimensional gas of massless dirac fermions in graphene. Nature, 438:197–200, 2005.
- B. Sepúlveda, P. C. Angelomé, L. M. Lechuga, and L. M. Liz-Marzán. Lspr-based nanobiosensors. Nano Today, 2009.
- Z. Wang, R. Lévy, D. G. Fernig, and M. Brust. Kinase-catalyzed modification of gold nanoparticles: a new approach to colorimetric kinase activity screening. Journal of the American Chemical Society, 128 (7):2214–2215, 2006.
- P. M. Kosaka, Pini V., J. J. Ruz, R. A. da Silva, M. U. González, D Ramos, M Calleja, and J. Tamayo. Detection of cancer biomarkers in serum using a hybrid mechanical and optoplasmonic nanosensor. Nat Nano, 2014.
